Đã có kết quả bước đầu kiểm nghiệm chất lượng thuốc gây tê nghi khiến 2 sản phụ Đà Nẵng tử vong
Sau khi tại Bệnh viện Phụ nữ Đà Nẵng xảy ra những vụ tai biến sản khoa nghiêm trọng khiến 2 người tử vong, 1 người nguy kịch nghi do thuốc gây tê Bupivacaine wpw spinal 0 ,5% heavy (Bupivacaine 0,5% 20mg/4ml), Bộ Y tế đã tiến hành kiểm nghiệm chất lượng thuốc.
Chiều 29/11, ông Nguyễn Thành Lâm, Phó Cục trưởng Cục Quản lý dược (Bộ Y tế) cho hay 13/16 chỉ tiêu kiểm nghiệm xong, đều đạt yêu cầu. 3 chỉ tiêu nữa vẫn đang trong quá trình đánh giá, việc này cần có thêm thời gian thực hiện.
"Cuối tuần tới dự kiến sẽ có kết quả", ông Lâm khẳng định.
Trước đó, như Báo Gia đình & Xã hội đã đưa tin, trong vòng chưa đầy 1 tuần và 1 tháng qua, 3 sản phụ đến Bệnh viện Phụ nữ Đà Nẵng sinh, sau khi tiêm gây tê 2 người đã tử vong, 1 người nguy kịch.

Thứ trưởng Bộ Y tế Nguyễn Trường Sơn thăm bệnh nhân gặp tai biến sau tiêm gây tê tuỷ sống tại Bệnh viện Phụ nữ Đà Nẵng.
Hai sản phụ là V.T.N. S. (34 tuổi, trú quận Cẩm Lệ) và N.T.H (33 tuổi, trú quận Liên Chiểu, Đà Nẵng) vào viện cùng ngày 17/11. Lô thuốc 3 sản phụ này được tiêm đều được nhập từ ngày 22/10/2019.
Cục Quản lý Dược cho biết đã chỉ đạo Sở Y tế Đà Nẵng, chỉ đạo các cơ sở y tế trên địa bàn báo cáo tổng hợp những trường hợp tai biến xảy ra. Các báo cáo này phải được gửi kịp thời về Trung tâm thông tin và theo dõi tác dụng phụ của thuốc thuộc Bộ Y tế để phân tích, rà soát.
Sau khi xảy ra liên tiếp các vụ tai biến nghiêm trọng tại Đà Nẵng, Công ty cổ phần Dược phẩm CPC1 – đơn vị cung ứng thuốc này - đã có công văn gửi các sở y tế trong cả nước về việc tạm dừng cung ứng mặt hàng thuốc này và đề nghị các cơ sở y tế tạm dùng thuốc trong khi chờ các cơ quan kiểm nghiệm thuốc. Đồng thời, công ty cũng bố trí nguồn thuốc ở Pháp có cùng hoạt chất để các cơ sở y tế có nhu cầu sử dụng thuốc này.
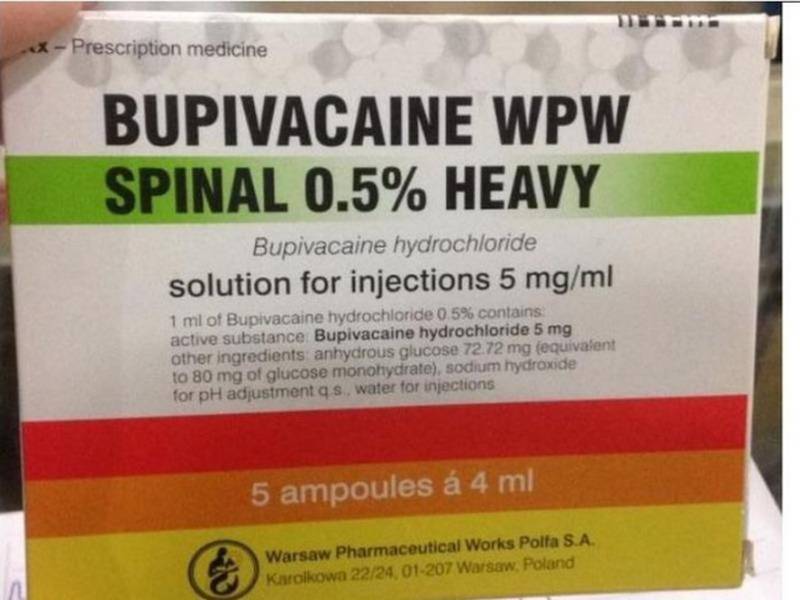
Nhiều địa phương đã tạm dừng sử dụng thuốc gây tê Bupivacaine do Ba Lan sản xuất.
Cục Quản lý Dược đã chỉ đạo các đơn vị chuyên môn rà soát lại các hồ sơ đăng ký; đẩy nhanh tốc độ cấp giấy đăng ký lưu hành để bổ sung thuốc cho các cơ sở y tế; chỉ đạo các cơ sở y tế trong danh mục mua sắm trúng thầu của mình, sử dụng các biện pháp mua sắm làm sao đảm bảo nguồn thuốc phục vụ công tác điều trị trong trường hợp cần sử dụng thuốc.
Trong năm nay, nhiều bệnh nhân tại Đồng bằng Sông Cửu Long (Long An, Bến Tre) cũng gặp những tai biến tương tự sau khi sử dụng 1 loại thuốc gây tê được sản xuất tại Ba Lan: Bupivacaine wpw spinal 0 ,5% heavy (Bupivacaine 0,5% 20mg/4ml).
Theo đại diện Sở Y tế Cần Thơ, thuốc gây tê Bupivacaine sản xuất tại Ba Lan đã trúng thầu cung ứng cho các bệnh viện từ năm 2019 do có giá rẻ hơn các thuốc cùng loại. Một số tỉnh như Long An, Bến Tre, Cần Thơ, Quảng Nam đã tạm dừng loại thuốc này, thay thế bằng loại thuốc do Pháp sản xuất.
Theo GiaDinh
- Cảnh báo bệnh về da thường gặp trong mùa hè và cách phòng tránh
- 6 lợi ích của loại trái cây thân thiện với bệnh tiểu đường
- Những thực phẩm này hâm lại có thể thành 'thuốc độc'
- Dùng quạt điện mùa hè nên để quay hay đứng yên?
- Kiếm 1,8 tỷ đồng mỗi năm nhờ nghề thử thức ăn cho thú cưng
- Ngược dòng thế giới, giá vàng SJC lại tăng nhanh
- Thời điểm uống thuốc cao huyết áp tốt nhất trong ngày, người bệnh cao huyết áp phải biết điều này
- Muôn kiểu thủ đoạn lừa đảo trên không gian mạng, người dân cần trang bị những gì?
- Bé gái 12 tuổi ở Hà Nội sinh con do bị hi.ế.p dâm: Công an lấy mẫu ADN điều tra
- Tin sáng 18/4: Sắp hạn chế biểu diễn đối với nghệ sĩ vi phạm; diễn biến mới vụ bé gái 12 tuổi ở Hà Nội sắp sinh con
- 5 con giáp vận đỏ gõ cửa vào tuần cuối cùng của năm 2023 dương lịch
- Sai lầm khi ngủ trưa nhân viên văn phòng nào cũng mắc phải
- Dùng "combo" thuốc bột và hồng ngâm, người đàn ông ở Hà Nội nôn dịch xanh đen
- Tưởng chừng chỉ bị hạch bạch huyết thông thường, hóa ra người phụ nữ này bị ung thư đã 5 năm
- Chóng mặt, tê mỏi - 'hội chứng nhà hàng Trung Quốc' - thực chất do đâu?
- Dễ đến 90% người Việt có hơn 2 trong số 6 thói quen xấu này trong bữa ăn, khiến bệnh tật sớm tìm đến
- Con không đi học thêm, phụ huynh vẫn đóng tiền học cả năm
- Dấu hiệu cảnh báo ung thư đường tiết niệu dễ nhận biết
- Chuyên gia cảnh báo ngủ lâu hơn con số này, nguy cơ tử vong sớm càng cao
- Bộ GD&ĐT bỏ thi chứng chỉ ngoại ngữ
- Hai học sinh ở Lâm Đồng bị đánh nhầm đến nguy kịch
- Người đàn ông giật túi xách khi đi mua cháo cho con
- Từ 1/7/2024 không cần hộ chiếu (passport) người đi máy bay chỉ phải mang theo một loại giấy tờ này
- Tin sáng 18/4: Sắp hạn chế biểu diễn đối với nghệ sĩ vi phạm; diễn biến mới vụ bé gái 12 tuổi ở Hà Nội sắp sinh con
- Bé gái 12 tuổi ở Hà Nội sinh con do bị hi.ế.p dâm: Công an lấy mẫu ADN điều tra
- Muôn kiểu thủ đoạn lừa đảo trên không gian mạng, người dân cần trang bị những gì?
- Thời điểm uống thuốc cao huyết áp tốt nhất trong ngày, người bệnh cao huyết áp phải biết điều này
- Ngược dòng thế giới, giá vàng SJC lại tăng nhanh
- Kiếm 1,8 tỷ đồng mỗi năm nhờ nghề thử thức ăn cho thú cưng
- Dùng quạt điện mùa hè nên để quay hay đứng yên?
- Hai học sinh ở Lâm Đồng bị đánh nhầm đến nguy kịch
- Người đàn ông giật túi xách khi đi mua cháo cho con
- Từ 1/7/2024 không cần hộ chiếu (passport) người đi máy bay chỉ phải mang theo một loại giấy tờ này
- Tin sáng 18/4: Sắp hạn chế biểu diễn đối với nghệ sĩ vi phạm; diễn biến mới vụ bé gái 12 tuổi ở Hà Nội sắp sinh con
- Bé gái 12 tuổi ở Hà Nội sinh con do bị hi.ế.p dâm: Công an lấy mẫu ADN điều tra
- Chuyện lạ ở Lâm Đồng: 3 chị em ruột cưới cùng 1 ngày, tất cả cùng đến hôn trường tiệc cưới
- Muôn kiểu thủ đoạn lừa đảo trên không gian mạng, người dân cần trang bị những gì?
- Thời điểm uống thuốc cao huyết áp tốt nhất trong ngày, người bệnh cao huyết áp phải biết điều này
- Ngược dòng thế giới, giá vàng SJC lại tăng nhanh
- Kiếm 1,8 tỷ đồng mỗi năm nhờ nghề thử thức ăn cho thú cưng



